








Las reacciones químicas

Observa los pasos necesarios para llevar a cabo el ajuste de la siguiente ecuación química:
Ajuste e interpretación de ecuaciones químicas

Interpretación
El propano (C
3
H
8
) y el oxígeno (O
2
) reaccionan entre sí para formar dióxido de carbono
(CO
2
) y agua (H
2
O), y lo hacen en la siguiente proporción:

Para
ajustar
una
reacción,
debemos
conseguir
que
el
número
de
átomos
de
cada
elemento
sea
el
mismo
antes
y
después
de
la
reacción.
En
este
caso,
debe
haber
los
mismos
átomos
de
C,
de
H
y
de
O
en
los
reactivos
y
en
los
productos.

Por
tanto,
comenzamos
dibujado
una
molécula
de
cada
sustancia,
a
partir
de
las
proprciones
indicadas
por
su
fórmula
química,
y
hacemos
un
primer
recuento
de
los
átomos
que
hay
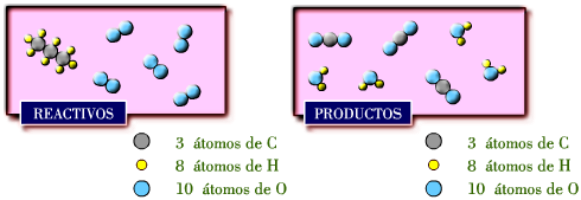
antes y después de la reacción.
Fíjate
como
el
número
de
átomos
de
cada
elemento
en
reactivos
y
productos
no
es
el
mismo,
por
lo
que
debemos
modificar
las
moléculas
dibujadas
para
conseguir
que
coincidan.
En
este
caso,
para
tener
los
8
átomos
de
hidrógeno
en
productos
dibujaremos
3
moléculas
más
de
agua
(H
2
O),
y
2
moléculas
más
de
dióxido
de
carbono
(CO
2
)
en
los
productos
también
para
igualar
el
número
de
átomos
de
carbono
(C)
en
reactivos
y
productos.
Al
tiempo
que
hacemos
esto,
vamos
modificando
los
coeficientes
estequiométricos correspondientes a las sustancias indicadas:
Finalmente
damos
por
ajustada
la
reacción
cuando
conseguimos
el
mismo
número
de
átomos
de
cada
elemento
antes
y
después
de
la
misma-.
Ahora
sólo
queda
realizar
una
interpretación
del
proceso,
expresando
microscópicamente
lo
que
está
ocurriendo,
indicando
las
moléculas
implicadas
de
cada
una
de
las
sustancias,
de
acuerdo
con
los
correspodientes coeficientes estequiométricos.


Cada molécula de propano que reacciona con 5 moléculas de oxígeno
producen 3 moléculas de dióxido de carbono y 4 moléculas de agua..

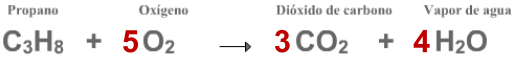


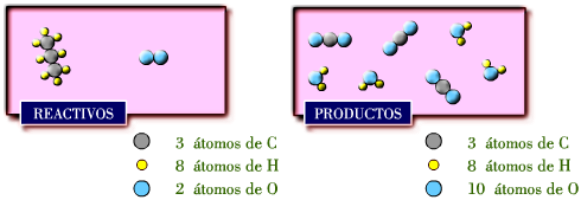
Aunque
te
darás
cuenta
de
que
todavía
no
está
ajustada
la
reacción,
ya
que
el
número
de
átomos
de
oxígeno
(O)
no
coincide.
Para
terminar,
habrá
que
añadir
4
moléculas
más
de
oxígeno
gaseoso
(O
2
)
en
los
reactivos,
y
actualizar
su
coeficiente
estequiométrico.
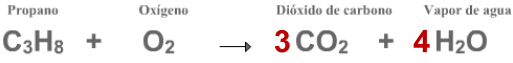

Estás en: Inicio > Materiales > Aplicaciones> Las reacciones químicas



